Reaksi Berikut Dapat Berlangsung Kecuali Reaksi Antara: Dunia kimia penuh keajaiban reaksi-reaksi yang membentuk dan mengubah materi di sekitar kita. Dari proses sederhana seperti pembakaran lilin hingga reaksi kompleks dalam tubuh manusia, semuanya melibatkan interaksi antara zat-zat kimia. Namun, tidak semua zat bereaksi satu sama lain. Memahami kondisi apa yang memungkinkan atau mencegah reaksi kimia terjadi sangatlah penting, karena hal ini memungkinkan kita untuk memprediksi dan mengendalikan perubahan kimia yang terjadi.
Topik ini akan mengeksplorasi berbagai jenis reaksi kimia, faktor-faktor yang mempengaruhi keberlangsungannya, dan khususnya, menganalisis beberapa pasangan reaktan yang tidak akan bereaksi. Kita akan mempelajari konsep energi aktivasi, termodinamika, dan kinetika reaksi untuk menjelaskan mengapa beberapa reaksi kimia dapat berlangsung sementara yang lain tidak. Dengan pemahaman yang lebih baik tentang prinsip-prinsip ini, kita dapat memahami dunia kimia dengan lebih mendalam.
Pengantar Reaksi Kimia
Reaksi kimia merupakan proses perubahan zat yang melibatkan penataan ulang atom-atom, molekul-molekul, atau ion-ion, menghasilkan zat baru dengan sifat yang berbeda dari zat semula. Proses ini dipengaruhi oleh berbagai faktor, termasuk konsentrasi reaktan, suhu, tekanan, dan keberadaan katalis. Pemahaman tentang reaksi kimia sangat penting dalam berbagai bidang, mulai dari industri hingga kehidupan sehari-hari.
Reaksi kimia terjadi di sekitar kita setiap saat, seringkali tanpa kita sadari. Proses pembakaran bahan bakar, fotosintesis pada tumbuhan, dan pencernaan makanan merupakan contoh reaksi kimia yang umum terjadi.
Perbandingan Reaksi Eksoterm dan Endoterm
Reaksi kimia dapat dikategorikan menjadi dua jenis utama berdasarkan perubahan energi panas: reaksi eksoterm dan reaksi endoterm. Tabel berikut membandingkan kedua jenis reaksi tersebut.
| Karakteristik | Reaksi Eksoterm | Reaksi Endoterm |
|---|---|---|
| Perubahan Energi | Membebaskan energi panas ke lingkungan | Menerima energi panas dari lingkungan |
| Perubahan Entalpi (ΔH) | ΔH < 0 (negatif) | ΔH > 0 (positif) |
| Contoh | Pembakaran kayu, reaksi netralisasi asam-basa | Fotosintesis, peleburan es |
Perbedaan Reaksi Kimia dan Perubahan Fisika
Meskipun keduanya melibatkan perubahan zat, reaksi kimia dan perubahan fisika memiliki perbedaan mendasar. Berikut perbedaan utamanya:
- Reaksi kimia menghasilkan zat baru dengan sifat yang berbeda, sedangkan perubahan fisika hanya mengubah bentuk atau wujud zat tanpa mengubah komposisi kimianya.
- Reaksi kimia melibatkan pemutusan dan pembentukan ikatan kimia, sementara perubahan fisika tidak.
- Reaksi kimia seringkali disertai dengan perubahan energi yang signifikan (panas, cahaya), sedangkan perubahan fisika umumnya tidak.
- Reaksi kimia sulit dibalik, sedangkan perubahan fisika seringkali mudah dibalik.
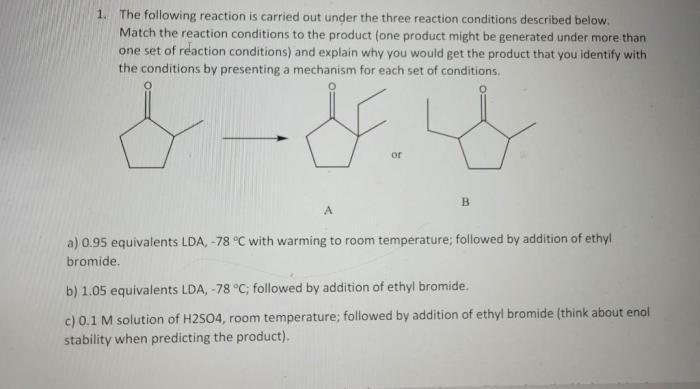
Ilustrasi Reaksi Kimia Tingkat Molekul, Reaksi berikut dapat berlangsung kecuali reaksi antara
Bayangkan reaksi sederhana antara hidrogen (H₂) dan oksigen (O₂) membentuk air (H₂O). Pada tingkat molekul, reaksi ini melibatkan pemutusan ikatan kovalen dalam molekul H₂ dan O₂, kemudian pembentukan ikatan kovalen baru untuk membentuk molekul H₂O. Molekul H₂ dan O₂ yang awalnya terpisah, bertabrakan dengan energi yang cukup untuk mematahkan ikatan mereka. Atom-atom hidrogen dan oksigen kemudian bergabung kembali membentuk molekul air.
Proses ini menghasilkan pelepasan energi dalam bentuk panas, sesuai dengan sifat reaksi eksoterm dari reaksi ini. Ilustrasi ini menunjukkan bagaimana penataan ulang atom-atom menghasilkan zat baru dengan sifat yang berbeda.
Jenis-jenis Reaksi Kimia
Reaksi kimia merupakan proses perubahan zat yang melibatkan perubahan susunan atom-atom dalam molekul. Memahami jenis-jenis reaksi kimia sangat penting untuk memprediksi produk reaksi dan mengontrol proses kimia. Klasifikasi reaksi kimia membantu kita dalam menganalisis dan memahami berbagai fenomena kimia yang terjadi di sekitar kita, mulai dari proses sederhana hingga yang kompleks.
Empat Jenis Reaksi Kimia Utama
Reaksi kimia diklasifikasikan ke dalam beberapa jenis berdasarkan mekanisme reaksinya. Berikut empat jenis reaksi kimia utama yang sering dipelajari:
- Sintesis (Penggabungan): Reaksi ini melibatkan penggabungan dua atau lebih reaktan untuk membentuk satu produk yang lebih kompleks. Contohnya adalah reaksi pembentukan air dari hidrogen dan oksigen: 2H₂ + O₂ → 2H₂O. Dalam reaksi ini, dua molekul hidrogen dan satu molekul oksigen bergabung membentuk dua molekul air. Persamaan reaksi tersebut sudah setara.
- Dekomposisi (Penguraian): Reaksi ini merupakan kebalikan dari sintesis, di mana satu reaktan terurai menjadi dua atau lebih produk yang lebih sederhana. Contohnya adalah penguraian kalsium karbonat menjadi kalsium oksida dan karbon dioksida: CaCO₃ → CaO + CO₂. Persamaan reaksi sudah setara.
- Penggantian Tunggal (Substitusi): Reaksi ini melibatkan penggantian satu atom atau gugus atom dalam suatu senyawa oleh atom atau gugus atom lain. Contohnya adalah reaksi antara seng dan asam klorida: Zn + 2HCl → ZnCl₂ + H₂. Dalam reaksi ini, atom seng menggantikan atom hidrogen dalam asam klorida. Persamaan reaksi sudah setara.
- Penggantian Ganda (Metatesis): Reaksi ini melibatkan pertukaran ion antara dua senyawa. Contohnya adalah reaksi antara perak nitrat dan natrium klorida: AgNO₃ + NaCl → AgCl + NaNO₃. Dalam reaksi ini, ion perak dan ion natrium saling bertukar tempat. Persamaan reaksi sudah setara.
Reaksi Redoks
Reaksi redoks (reduksi-oksidasi) adalah reaksi kimia yang melibatkan transfer elektron antara dua spesies. Spesies yang kehilangan elektron mengalami oksidasi, sedangkan spesies yang menerima elektron mengalami reduksi. Reaksi redoks sangat penting dalam berbagai proses biologis dan industri. Salah satu ciri khas reaksi redoks adalah adanya perubahan bilangan oksidasi atom-atom yang terlibat.
Menyeimbangkan Persamaan Reaksi Kimia
Menyeimbangkan persamaan reaksi kimia berarti memastikan jumlah atom setiap unsur sama pada kedua sisi persamaan (reaktan dan produk). Hal ini dilakukan dengan menambahkan koefisien di depan rumus kimia. Proses penyeimbangan persamaan reaksi untuk keempat jenis reaksi di atas telah didemonstrasikan pada contoh-contoh yang diberikan sebelumnya.
Perbedaan Keempat Jenis Reaksi Kimia
| Jenis Reaksi | Reaktan | Produk | Karakteristik |
|---|---|---|---|
| Sintesis | Dua atau lebih zat | Satu zat yang lebih kompleks | Penggabungan zat-zat |
| Dekomposisi | Satu zat | Dua atau lebih zat yang lebih sederhana | Penguraian zat |
| Penggantian Tunggal | Satu unsur dan satu senyawa | Satu unsur dan satu senyawa baru | Penggantian satu unsur oleh unsur lain |
| Penggantian Ganda | Dua senyawa | Dua senyawa baru | Pertukaran ion antara dua senyawa |
Reaksi yang Tidak Dapat Berlangsung: Reaksi Berikut Dapat Berlangsung Kecuali Reaksi Antara

Tidak semua reaksi kimia yang secara teoritis mungkin dapat berlangsung dalam praktiknya. Beberapa reaksi terhalang oleh berbagai faktor, baik dari sisi termodinamika maupun kinetika. Pemahaman mengenai faktor-faktor ini krusial dalam memprediksi dan mengendalikan reaksi kimia.
Kondisi yang Menghambat Terjadinya Reaksi Kimia
Reaksi kimia hanya akan berlangsung jika memenuhi dua syarat utama: termodinamika yang menguntungkan dan kinetika yang memungkinkan. Reaksi yang tidak menguntungkan secara termodinamika (ΔG > 0) tidak akan berlangsung secara spontan, meskipun kinetikanya memungkinkan. Sebaliknya, reaksi yang meskipun menguntungkan secara termodinamika (ΔG < 0) tetapi memiliki energi aktivasi yang sangat tinggi, juga akan berlangsung sangat lambat atau bahkan tidak berlangsung sama sekali.
Contoh Reaksi yang Tidak Memungkinkan Secara Termodinamika
Salah satu contoh reaksi yang secara termodinamika tidak memungkinkan adalah pembentukan air dari hidrogen dan oksigen pada suhu kamar dan tekanan standar. Meskipun reaksi ini sangat eksotermik dan menghasilkan ΔG yang negatif, reaksi ini tidak akan terjadi secara spontan tanpa adanya energi aktivasi (misalnya, percikan api). Hal ini karena energi aktivasi yang dibutuhkan untuk memecah ikatan H-H dan O=O cukup tinggi.
Peran Energi Aktivasi dalam Menentukan Berlangsungnya Reaksi
Energi aktivasi (Ea) adalah energi minimum yang dibutuhkan untuk memulai reaksi kimia. Ia merepresentasikan hambatan energi yang harus diatasi oleh reaktan agar dapat berubah menjadi produk. Semakin tinggi energi aktivasi, semakin lambat laju reaksi, dan semakin kecil kemungkinan reaksi berlangsung. Ilustrasi di bawah ini akan menjelaskan lebih detail.
Faktor-Faktor Kinetika yang Mempengaruhi Laju Reaksi
Selain energi aktivasi, beberapa faktor kinetika lain juga mempengaruhi laju reaksi dan kemungkinan reaksi berlangsung. Faktor-faktor ini antara lain konsentrasi reaktan, suhu, luas permukaan (untuk reaksi heterogen), dan keberadaan katalis. Konsentrasi reaktan yang lebih tinggi akan meningkatkan frekuensi tumbukan antar molekul, sehingga meningkatkan laju reaksi. Peningkatan suhu meningkatkan energi kinetik molekul, sehingga lebih banyak molekul yang memiliki energi yang cukup untuk mengatasi energi aktivasi.
Luas permukaan yang lebih besar pada reaksi heterogen meningkatkan jumlah tempat kontak antara reaktan, sehingga meningkatkan laju reaksi. Katalis menurunkan energi aktivasi, sehingga meningkatkan laju reaksi.
Ilustrasi Pengaruh Energi Aktivasi terhadap Laju Reaksi
Bayangkan sebuah grafik dengan sumbu Y mewakili energi dan sumbu X mewakili koordinat reaksi. Kurva energi potensial akan menunjukkan energi reaktan, energi aktivasi (puncak kurva), dan energi produk. Reaksi dengan energi aktivasi yang rendah akan memiliki kurva dengan puncak yang rendah, sehingga lebih mudah bagi reaktan untuk mencapai keadaan transisi dan membentuk produk. Sebaliknya, reaksi dengan energi aktivasi yang tinggi akan memiliki kurva dengan puncak yang tinggi, sehingga hanya sedikit molekul yang memiliki energi cukup untuk mengatasi hambatan energi dan membentuk produk, sehingga reaksi berlangsung sangat lambat atau bahkan tidak berlangsung.
Analisis Reaksi Khusus
Reaksi kimia, meskipun tampak sederhana, tergantung pada berbagai faktor yang menentukan apakah reaksi tersebut akan berlangsung atau tidak. Tidak semua zat akan bereaksi satu sama lain, bahkan jika secara teori seharusnya bereaksi. Analisis reaksi khusus ini akan mengkaji beberapa pasangan reaktan yang tidak bereaksi dan menjelaskan mengapa hal tersebut terjadi.
Pemahaman mengenai kondisi-kondisi yang menghambat reaksi kimia sangat penting dalam berbagai bidang, mulai dari sintesis bahan kimia hingga pemahaman proses-proses alamiah. Dengan memahami faktor-faktor ini, kita dapat memprediksi dan mengendalikan reaksi kimia dengan lebih efektif.
Pasangan Reaksi yang Tidak Berlangsung
Berikut beberapa contoh pasangan reaktan yang, dalam kondisi normal, tidak akan bereaksi. Penjelasan lebih rinci akan diberikan untuk masing-masing pasangan.
| Reaktan 1 | Reaktan 2 | Penjelasan |
|---|---|---|
| Emas (Au) | Air (H₂O) | Emas bersifat sangat inert (tidak reaktif) dan tidak bereaksi dengan air dalam kondisi standar. Ikatan logam dalam emas sangat kuat dan membutuhkan energi aktivasi yang sangat tinggi untuk diputus. |
| Nitrogen (N₂) | Oksigen (O₂) | Meskipun keduanya merupakan komponen utama udara, nitrogen memiliki ikatan rangkap tiga yang sangat kuat, sehingga membutuhkan energi aktivasi yang tinggi untuk bereaksi dengan oksigen. Reaksi hanya akan terjadi pada suhu dan tekanan yang sangat tinggi, seperti dalam proses pembuatan amonia (Haber-Bosch). |
| Tembaga (Cu) | Asam Klorida encer (HCl) | Tembaga kurang reaktif dibandingkan hidrogen dalam deret aktivitas logam. Oleh karena itu, tembaga tidak dapat menggeser hidrogen dari asam klorida encer. Reaksi hanya akan terjadi jika asam klorida pekat dan dalam kondisi oksidasi. |
| Perak (Ag) | Asam Sulfat encer (H₂SO₄) | Mirip dengan tembaga, perak kurang reaktif dibandingkan hidrogen dan tidak dapat menggeser hidrogen dari asam sulfat encer. Reaksi hanya mungkin terjadi dengan asam sulfat pekat dan panas, yang merupakan kondisi oksidatif kuat. |
Kondisi yang Mencegah Reaksi Kimia
Kondisi-kondisi umum yang mencegah reaksi kimia berlangsung meliputi: energi aktivasi yang tinggi, ketidaksesuaian geometri molekul untuk membentuk kompleks teraktivasi, ketidakstabilan produk, dan kurangnya kontak antar reaktan. Selain itu, faktor-faktor seperti pH, suhu, dan tekanan juga berperan penting.
Reaksi yang Bergantung pada Kondisi
Beberapa reaksi hanya berlangsung dalam kondisi tertentu. Sebagai contoh, reaksi antara besi (Fe) dan air (H₂O) hanya terjadi jika terdapat oksigen (O₂) sebagai oksidator. Dalam kondisi tanpa oksigen, besi hanya akan berkarat secara perlahan melalui reaksi dengan air saja, menghasilkan besi(II) hidroksida. Namun, dengan adanya oksigen, besi akan berkarat lebih cepat membentuk besi(III) oksida hidrat (karat).
Kesimpulan

Kesimpulannya, kemampuan memprediksi apakah suatu reaksi kimia akan berlangsung atau tidak merupakan keterampilan penting dalam kimia. Memahami faktor-faktor seperti termodinamika, kinetika, dan sifat reaktan sangat krusial. Meskipun banyak reaksi kimia dapat diprediksi berdasarkan prinsip-prinsip dasar, selalu ada kemungkinan pengecualian dan faktor-faktor yang tidak terduga yang dapat mempengaruhi hasil reaksi. Oleh karena itu, pemahaman yang komprehensif tentang prinsip-prinsip reaksi kimia sangat penting, baik untuk aplikasi praktis maupun pemahaman ilmiah yang lebih dalam.